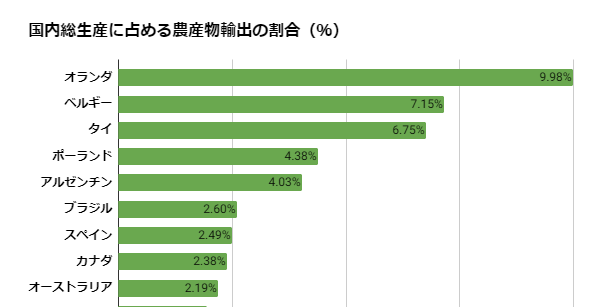
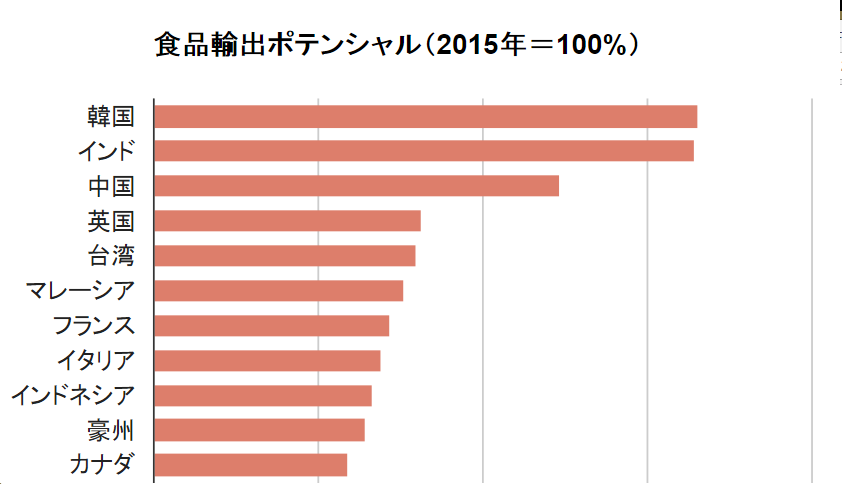
急にFDA 査察の事前通知 を受け取って、その対応にご苦労された方もいらっしゃると思います。
担当官がアメリカから来日し、数日間に渡って工場を視察し、書類を確認されます。
どう準備して、どのように対応すべきなのか。
今回、FDA査察のプロセスについて、立ち会う機会を頂戴しました。
その内容について、差し支えのない範囲でご説明したいと思います。
Day-140: 査察の事前通知 が届いた!
ある朝、懇意にしている経営者の方から「アメリカFDA査察の事前通知が来た。対応について相談に乗ってほしい」との連絡を受けました。
社内の役職宛に、「USFDA Foreign Food Inspection Planning」から「USFDA Notification of Inspection」(米国FDA査察通知)という英文メールが送られてきた、とのことです。
お話を聞くと、
- 査察通知の連絡、そして「施設概要確認書 Company profile」が送られてきた
- 施設概要確認書の回答期限は5日間であり、記載内容について相談したい
とのこと。
回答期限まであまり時間がないので、さっそくメールを転送していただき、スケジュールを調整して翌朝一番で打合せをすることにしました。
ちなみに、この章のタイトル「Day-140」とは、実際の査察日の140日前(約5カ月前)を指しています。
査察を振り返ると、5カ月前に事前通知を受け取ったことになります。
査察受入れの心構え
実は、私自身、FDA食品製造施設査察については、初めての経験です。
まして、食品製造技術や食品衛生管理については、まったくの素人です。
かつて、海外で、まったく分野の異なる監査を受け入れたり、逆に監査を行った経験がある程度です。
その時は、かなり特殊で厳しい監査だったこともあり、未知の監査に対する心構えだけはありました。
これまでの体験から、受動的に監査を受け入れるよりも、積極的に監査に対応することの方が、良い結果につながる、と考えていました。
たぶん、それは間違っていない、と思います。
そして、会議や作業の合間に、できるだけの情報収集を行いました。
とりわけ、以前にJETROのFDA査察対応セミナーや米国食品安全強化法(FSMA)セミナーを受けたことが幸いしました。
セミナーにて頂戴した資料を見ながら、過不足の無い対応を見極めようと考えました。
査察準備に役立った参考資料とは
その中でも大変参考になったのは、以下の2点です。
- 「FDA査察への対応(T社の事例)」
- 「FDA査察ガイドブック(第2版)」
https://www.jetro.go.jp/ext_images/world/n_america/…/fsma_seminar201502_5.pdf
一言で言えば、「査察ケーススタディ」です。
FDA査察日程、受け入れ準備(体制・資料)、リハーサル、査察当日スケジュール、査察状況、指摘事項、改善回答書、査察結果受領までの、一連の流れを把握することができます。
https://www.jetro.go.jp/world/reports/2018/02/4c23928336f1d473.html
FDA査察の概要(事前通知~査察当日~査察報告書受領までの流れ)、食品種別に応じた査察ポイントと事例、FAQ(よくある質問)が、丁寧に細かく整理されています。
FDA査察が終わった今、振り返ってみても、この「FDA査察対応の初動段階」では、この2点をきっちり読み込んでおけば、まず十分だと思われます。
「(1)T社ケース」: FDA査察の全体を俯瞰することができます。
「(2)FDA査察ガイドブック」: 具体的な対応内容を把握することができます。
特に、事前通知メールの記載内容で確認すべき重要なポイント、期限が迫っている「施設概要確認書 Company profile」の意味や意図、を考える上では、「(2)FDA査察ガイドブック」は、重要だと思います。
査察対象となる商品はどれ?
さて、肝心の「査察対象となる商品」が一体どの商品なのか、については、査察事前通知メールを読み解く必要があります。
なぜなら、商品を特定できないと、査察対象となる工場や製造工程を絞り込めないからです。
このメール、英語と日本語と、一見すると同じフォーマットの内容が記載されています。
ところが、「査察対象となる商品」は、英文の方にしか記載されていません。
しかも、具体的な「商品名」が記載されているわけでもなく、「商品種類」が記載されているだけです。
そのため、「商品種類」の記述内容から、商品を特定するしかありません。
「商品種類」を元にヒアリングして初めて商品を特定することができました。
- OEMで食品を製造している
- その商品が、アメリカへ輸出されている(商社経由)
- FDA食品登録は、商社にて行われており、登録内容を把握している
とのこと。
商社による食品登録のコピーを頂戴して、ようやく商品を特定することができました。
施設概要確認書 Company profile の作成
「(2)FDA査察ガイドブック」を参考にしながら、さっそく「施設概要確認書 Company profile」の叩き台を作成しました。
ちなみに、「施設概要確認書 Company profile」の作成方法について、です。
このファイルは、PDF形式になっています。
その時は気付かなかったのですが、アドビ社の「Adobe Acrobat Reader DC」というソフトを使って、このファイルを開くと、入力欄が現れます。
その入力欄に会社名などを入力し、ファイルを保存することができるのです。
ご注意ください。
アドビ社は、PDFを開発した会社です。
「Adobe Acrobat Reader DC」は、以下からダウンロードすることができます。
https://get.adobe.com/jp/reader/
翌日の打合せでは、
- FDA査察の概要(上記2点の資料を紹介し、流れを説明)
- 「施設概要確認書 Company profile」叩き台
- 懸案事項
- 今後の進め方
を確認、相談させていただきました。
打合せ後に、回答メールの文面を作成し、査察受入担当者とメールと電話でやり取りして「施設概要確認書」を最終化し、担当者よりFDAへ回答をお送りいただきました。
その後、すぐに回答メール受領の連絡メールが届き、とりあえず初動段階の作業を完了。
ほっとしました。
ライター: 植草 啓和(JBマーケット)
優れた日本の商材を国内、海外へ。
https://jbmarket.jp